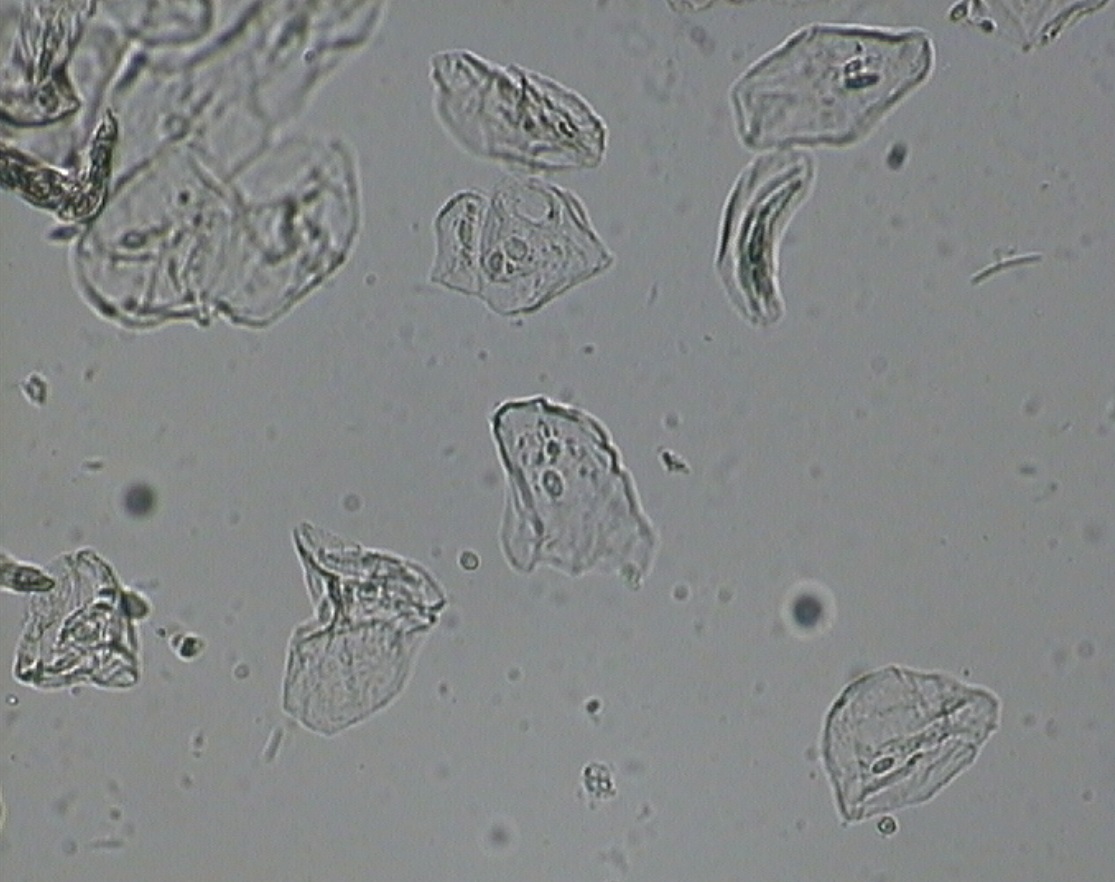
Cellule animali al microscopio
Le pareti interne delle nostre guance sono costituite da mucosa orale, un tessuto che, verso l'interno della bocca, è costituito da cellule facilmente sfaldabili. Per questo è semplice prelevarne una piccola quantità e osservarle al microscopio.
Yogurt al microscopio
Lo yogurt è ottenuto dalla fermentazione del latte operata da alcuni batteri, chiamati per questo fermenti lattici. Questi rimangono vivi nello yogurt, e possono entrare a far parte della flora batterica intestinale, diventando così simbionti del nostro organismo.
Scopo di quest'esperienza è quello di osservare al microscopio questi batteri.
Prova della catalasi
Durata: 15'
Scopo:
Distinguere i microrganismi in base
alla produzione di catalasi
Teoria:
La
maggior parte degli organismi aerobi (e anche alcuni organismi
anaerobi) producono l'enzima catalasi, per proteggersi dagli effetti
dell'acqua ossigenata, che è un sottoprodotto del metabolismo
aerobio, potenzialmente in grado di danneggiare le strutture
cellulari. La catalasi catalizza la reazione:
2H2O2
(aq) → 2H2O
(l) + O2
(g)
Verificare la presenza di
catalasi permette di distinguere i microrganismi produttori di
catalasi da quelli che non la producono.
Materiale:
- Piastra contenente la colonia da osservare
- Acqua ossigenata
Strumenti:
- Vetrino da orologio
- Ansa sterile in plastica
- Becco Bunsen
Procedimento (lavorare sotto cappa a flusso laminare):
- Depositare una goccia di acqua
ossigenata sul vetrino da orologio
- Sistemare la piastra capovolta sotto cappa
- Sollevare il fondo della
piastra, prelevare con l'ansa una piccola parte di colonia, e
richiudere la piastra
- Stemperare con l'ansa il campione prelevato nella goccia di acqua ossigenata sul vetrino.
Risultato:
Se i microrganismi sono catalasi
+, si sviluppa effervescenza, in caso contrario no.
Commenti:
Può essere necessario attendere
qualche minuto prima di osservare l'effervescenza. Non usare anse
metalliche, perché il metallo può ossidarsi o catalizzare la
reazione.
Cellule vegetali al microscopio
 |
| Cellule di spinacio, sono evidenti i cloroplasti (obiettivo 40x, oculare 10x) |
Osmosi in cellule di cipolla rossa
Durata: 1 ora
Scopo:
Osservare al
microscopio il fenomeno dell'osmosi in cellule vegetali.
Teoria:
La membrana cellulare
è una membrana semipermeabile, cioè può essere attraversata
dall'acqua ma non dai suoi soluti. Per il fenomeno dell'osmosi,
l'acqua attraversa spontaneamente la membrana andando dalla parte
dove c'è una minor concentrazione di soluti alla parte dove la
concentrazione è maggiore. Poiché le cellule hanno al loro interno
una certa concentrazione di soluti, se l'ambiente esterno ha una
concentrazione di soluti minore (soluzione ipotonica) l'acqua tende
ad entrare nelle cellule, gonfiandole, se invece l'ambiente esterno
ha una concentrazione maggiore (soluzione ipertonica) l'acqua tende a
uscire dalle cellule, facendole raggrinzire. Nel caso delle cellule
vegetali, la parete cellulare evita che le cellule si gonfino fino a
scoppiare se immerse in una soluzione ipotonica, ma se immerse in una
soluzione ipertonica, le cellule raggrinziscono e il citoplasma si
stacca dalle pareti cellulari.
Materiale:
- Cipolla rossa (o radicchio rosso, o cavolo cappuccio rosso)
- Soluzione fisiologica in contagocce
- Soluzione di NaCl al 10% in contagocce
- Acqua distillata in contagocce
Strumenti:
- Pinzette
- Vetrino portaoggetti
- Vetrino coprioggetto
- Microscopio
Procedimento:
- Depositare una goccia di soluzione fisiologica sul vetrino portaggetti
- Con una pinzetta, staccare un frammento di epidermide di cipolla rossa e depositarlo nella goccia sul vetrino. Il frammento deve essere almeno in parte viola.
- Coprire con il vetrino coprioggetto.
- Osservare al microscopio all'ingrandimento 10x
- Continuando ad osservare al microscopio, depositare una goccia della soluzione di NaCl al 10% sul vetrino portaoggetti a lato del vetrino coprioggetto, in modo che la goccia tocchi lateralmente il vetrino coprioggetto senza coprirlo.
- Dopo aver atteso qualche minuto osservando quello che succede, assorbire l'acqua in eccesso avvicinando un pezzo di carta assorbente al bordo del vetrino coprioggetto.
- Depositare una goccia di acqua distillata a lato del vetrino coprioggetto, e osservare quello che accade nel giro di alcuni minuti.
Risultato:
Quando viene aggiunta la
goccia di soluzione satura ai lati del vetrino, per capillarità
questa passa sotto di esso, mescolandosi con la soluzione
fisiologica. Quando la soluzione satura raggiunge il pezzo di
epidermide di radicchio rosso, dovrebbero essere evidenti i
citoplasmi viola che si staccano dalle pareti cellulari e
raggrinziscono.
Aggiungendo l'acqua
distillata, i citoplasmi raggrinziti dovrebbero aumentare un po' di
volume.
Note:
Se si usa il radicchio rosso o il cavolo cappuccio rosso, per ottenere un frammento di epidermide conviene grattare con la pinzetta la superficie inferiore della foglia finché non si solleva l'epidermide.
Quando si aggiungono le gocce a lato del vetrino coprioggetto il movimento della soluzione provocherà uno spostamento del campione, sarà quindi necessario correggere la messa a fuoco del microscopio.
Occorre fare molta attenzione affinché le soluzioni non vengano in contatto con nessuna parte del microscopio, in particolare con gli obiettivi: evaporando lasciano uno strato di cristalli di sale difficile da pulire.
Riferimenti:
- Biological Sciences Curriculum Study. BSCS Verde, 1, p. 100.
La muffa del Gorgonzola
Durata:
1,5 h preparazione del terreno, 1 ora sterilizzazione, ½ ora
semina, 2/3 giorni incubazione, 15' osservazione (+ tempo per
eventuali vetrini)
Scopo:
isolare e osservare la muffa del
Gorgonzola (Penicillium
roqueforti).
Materiale:
- Gorgonzola
- Per il terreno (Potato Dextrose Agar, 15 mL per piastra):
- Patate 200 g
- Glucosio 20 g
- Agar 15 g
- Acqua distillata 1000 mL
- Patate 200 g
Strumenti:
- Per il terreno:
- Becher
- Flacone con tappo a vite
- Cilindro graduato
- Bacchetta di vetro
- Vetrini da orologio
- Spatole
- Tagliere e coltello
- Colino o filtro
- Piastra riscaldante
- Bilancia tecnica
- Autoclave
- Piastre Petri
- Ansa
- Becco Bunsen
- Termostato (facoltativo)
Procedimento:
- Preparazione del terreno
- Pesare, pelare e sminuzzare le
patate
- Metterle in un becher con acqua
distillata e farle bollire per 1 ora su piastra riscaldante
(ATTENZIONE: usare calore moderato e mescolare spesso, fa molta
schiuma e può traboccare!)
- Filtrare il liquido versandolo
nel flacone con tappo a vite, buttare le patate
- Aggiungere il glucosio e l'agar
- Portare di nuovo a ebollizione
su piastra riscaldante, mescolando
- Sterilizzare in autoclave a 121°
C per 15'
- Pesare, pelare e sminuzzare le
patate
- Preparazione delle piastre (lavorare sterilmente vicino a
un Bunsen o sotto cappa a flusso laminare)
- Preparare le piastre col
coperchio verso l'alto vicino al Bunsen, e il flacone di terreno
ancora liquido ma che non scotti.
- Tenere il flacone con la mano
destra, aprire il tappo (che va tenuto in mano, a seconda di come
uno è più comodo tra il pollice e l'indice della mano destra o
sinistra) e flambare l'imboccatura del flacone.
- Aprire parzialmente la prima
piastra, versarvi il terreno fino a coprirne ¾ circa, richiudere
la piastra.
- Stendere uniformemente il
terreno nella piastra muovendola a 8 sul piano di lavoro.
- Lasciarla raffreddare col
coperchio semiaperto vicino al Bunsen (o sotto cappa a flusso
laminare)
- Ripetere i punti da 3 a 5 per
tutte le piastre.
- Una volta che si sono
raffreddate e non presentano più condensa, richiudere i coperchi.
- Preparare le piastre col
coperchio verso l'alto vicino al Bunsen, e il flacone di terreno
ancora liquido ma che non scotti.
- Semina (lavorare sterilmente vicino a un Bunsen o sotto
cappa a flusso laminare)
- Preparare le piastre col terreno
capovolte e il Gorgonzola vicino al Bunsen
- Sterilizzare l'ansa nella
fiamma, attendere 15' che si raffreddi
- Prelevare una piccola porzione
di muffa dal Gorgonzola
- Sollevare con la mano sinistra
il fondo di una piastra.
- Strisciare l'ansa sul terreno,
senza scavarlo.
- Richiudere la piastra.
- Ripetere i punti da 2 a 6 per
tutte le piastre, infine sterilizzare l'ansa nella fiamma.
- Scrivere sul bordo del coperchio
delle piastre il cognome, la classe, il contenuto (striscio da
Gorgonzola), il terreno (P.D.A.) e la data di semina.
- Preparare le piastre col terreno
capovolte e il Gorgonzola vicino al Bunsen
- Incubare a 25° per 2 o 3 giorni, o a temperatura ambiente
per almeno 3 giorni
- Osservare a occhio nudo, allo stereomicroscopio o al
microscopio preparando vetrini di muffa.
- Sterilizzare le piastre usate in autoclave a 121 °C per
15', usando un sacchetto da autoclave.
Risultato:
Dovrebbero crescere abbondanti
colonie lanose di muffa bianca e verde.
Microrganismi intorno a noi
Sono ovunque.
Nell'aria che respiriamo.
Sul terreno che calpestiamo.
Nel nostro cibo, sulla nostra pelle, anche dentro il nostro corpo.
Dagli abissi oceanici all'alta atmosfera, i microrganismi colonizzano pressoché ogni ambiente.
In questa esperienza cercheremo di coltivare quelli che vivono nel nostro stesso ambiente.
Nell'aria che respiriamo.
Sul terreno che calpestiamo.
Nel nostro cibo, sulla nostra pelle, anche dentro il nostro corpo.
Dagli abissi oceanici all'alta atmosfera, i microrganismi colonizzano pressoché ogni ambiente.
In questa esperienza cercheremo di coltivare quelli che vivono nel nostro stesso ambiente.
Lieviti dell'uva
Durata:
1 h preparazione del terreno, 1 ora sterilizzazione, ½ ora
semina, 3 giorni incubazione, 15' osservazione (+ tempo per eventuali
vetrini)
Scopo:
Isolare e osservare i lieviti
presenti sulla buccia dell'uva.
Materiale:
- Uva
- Per il terreno (15 mL per piastra):
- Estratto di lievito 10 g
- Glucosio 20 g
- Peptone 20 g
- Agar 15 g
- Acqua distillata 1000 mL
- Estratto di lievito 10 g
Strumenti:
- Per il terreno:
- Flacone con tappo a vite
- Cilindro graduato
- Bacchetta di vetro
- Vetrini da orologio
- Spatole
- Piastra riscaldante
- Bilancia tecnica
- Autoclave
- Contenitore autoclavabile
- Pestello
- Piastre Petri
- Ansa
- Becco Bunsen
- Cappa a flusso laminare
- Termostato
Procedimento:
- Preparazione del terreno
- Pesare l'estratto di lievito, il
glucosio, il peptone e l'agar e metterli nel flacone con tappo a
vite
- Aggiungere l'acqua distillata
- Portare a ebollizione su piastra
riscaldante, mescolando
- Sterilizzare in autoclave a 121°
C per 15', tenento il tappo non completamente chiuso, insieme ad un
contenitore e un pestello
- Pesare l'estratto di lievito, il
glucosio, il peptone e l'agar e metterli nel flacone con tappo a
vite
- Preparazione delle piastre (lavorare sterilmente vicino a
un Bunsen o sotto cappa a flusso laminare)
- Preparare le piastre col
coperchio verso l'alto vicino al Bunsen, e il flacone di terreno
ancora liquido ma che non scotti.
- Tenere il flacone con la mano
destra, aprire il tappo (che va tenuto in mano, a seconda di come
uno è più comodo tra il pollice e l'indice della mano destra o
sinistra) e flambare l'imboccatura del flacone.
- Aprire parzialmente la prima
piastra, versarvi il terreno fino a coprirne ¾ circa, richiudere
la piastra.
- Stendere uniformemente il
terreno nella piastra muovendola a 8 sul piano di lavoro.
- Lasciarla raffreddare col
coperchio semiaperto vicino al Bunsen (o sotto cappa a flusso
laminare)
- Ripetere i punti da 3 a 5 per
tutte le piastre.
- Una volta che si sono
raffreddate e non presentano più condensa, richiudere i coperchi.
- Preparare le piastre col
coperchio verso l'alto vicino al Bunsen, e il flacone di terreno
ancora liquido ma che non scotti.
- Semina (lavorare sterilmente vicino a un Bunsen o sotto
cappa a flusso laminare)
- Pestare l'uva nel contenitore
sterile con il pestello
- Preparare le piastre col terreno
capovolte
- Sterilizzare l'ansa nella
fiamma, attendere 15' che si raffreddi
- Prelevare con l'ansa una piccola
porzione del mosto pestato
- Sollevare con la mano sinistra
il fondo di una piastra.
- Strisciare l'ansa sul terreno,
senza scavarlo.
- Richiudere la piastra.
- Ripetere i punti da 2 a 6 per
tutte le piastre, infine sterilizzare l'ansa nella fiamma.
- Scrivere sul bordo del coperchio
delle piastre il cognome, la classe, il contenuto (striscio da
uva), il terreno e la data di semina.
- Pestare l'uva nel contenitore
sterile con il pestello
- Incubare a 25° per 3 giorni
- Osservare a occhio nudo, allo stereomicroscopio o al
microscopio preparando vetrini.
- Sterilizzare le piastre usate in autoclave a 121 °C per
15', usando un sacchetto da autoclave.
Risultato:
Lettere al microscopio
Durata: 1 ora
Scopo:
Prendere confidenza con il microscopio, in particolare la
preparazione di vetrini, la messa a fuoco ai diversi ingrandimenti e
il fatto che l'immagine osservata è speculare.
Materiale:
- Giornali o riviste (meglio se con carta chiara e sottile)
Strumenti:
- microscopio
- vetrini portaoggetto
- vetrini coprioggetto
- spruzzetta con acqua distillata
- pinzette
- forbici
Procedimento:
- Ritagliare una lettera (piccola)
da un giornale o rivista
- Metterla sul vetrino
portaoggetto, aggiungere una goccia d'acqua e coprirla con il
vetrino coprioggetto.
- Osservare come si presenta la
lettera ad occhio nudo.
- Accendere la luce del
microscopio, regolandola al minimo.
- Controllare che il diaframma sia
aperto al massimo.
- Abbassare il tavolino
portaoggetti, e posizionare il vetrino nel carrello traslatore.
- Traslare il vetrino fino a che la
lettera non sia al centro del fascio luminoso.
- Scegliere l'obiettivo 4x, e
alzare il tavolino portaoggetti fino a fine corsa.
- Guardando nell'oculare, muovere
la vite macrometrica fino ad una messa a fuoco accettabile.
- Regolare la luminosità in modo
che il campione si veda bene ma la luce non sia eccessiva.
- Muovere la vite micrometrica fino
alla messa a fuoco migliore.
- Osservare la lettera.
- Passare all'obiettivo 10x.
- Regolare la luminosità in modo
che il campione si veda bene ma la luce non sia eccessiva.
- Mettere a fuoco con al vite
micrometrica.
- Osservare la lettera.
- Passare all'obiettivo 40x,
ripetendo i punti dal 14 al 16.
Risultato:
Ci si accorgerà che l'immagine,
oltre ad essere ovviamente ingrandita, è capovolta; inoltre più si
aumenta l'ingrandimento più la luce che passa è minore, e più è
sottile la profondità di campo messo a fuoco.
Infuso di fieno
Durata: alcuni giorni incubazione, 1 ora osservazione
Scopo:
Osservare i protozoi
Materiale:
- Fieno (ma funziona anche con foglie secche)
- Acqua di rubinetto
Strumenti:
- Becher largo, pentolino o vaschetta
- Pipetta Pasteur
- Vetrino portaoggetti
- Vetrino coprioggetti
- Microscopio
Procedimento:
- Mettere un po' di fieno in un grande becher insieme ad acqua di rubinetto, e incubare per alcuni giorni (possibilmente sotto cappa aspirante per evitare cattivi odori)
- Con una pipetta Pasteur, depositare una goccia dell'infuso su un vetrino portaoggetti, e coprire con un vetrino coprioggetti
- Osservare al microscopio
- Sterilizzare i vetrini in alcool, e l'infuso di fieno in autoclave
Risultato:
Nell'infuso
dovrebbero svilupparsi diversi protozoi, soprattutto Colpoda,
ma anche Colops,
rotiferi e Paramecium.
Dovrebbero essere visibili anche numerosi batteri, mobili e immobili.
 |
| Infuso di fieno, obiettivo 10x, oculare 10x |
Elettroforesi del DNA - Scena del crimine
E' stato commesso un crimine, e gli investigatori hanno raccolto un mozzicone di sigaretta gettato dal criminale vicino al luogo del delitto. Ci sono tre sospetti senza ulteriori prove contro uno particolare dei tre, ma attraverso il DNA trovato sul mozzicone di sigaretta, la polizia scientifica riesce a scagionare due dei sospetti, individuando il colpevole.
Come è possibile questo? Da qualche decennio, il DNA fingerprinting permette di confrontare tra loro, in modo relativamente semplice, diversi DNA.
Questa esperienza ripropone in classe questa tecnica, usando un kit EDVOTEK, al quale si rimanda per la descrizione dettagliata del procedimento.
Dissezione di un mollusco
Durata: 1 ora
Scopo:
Studiare l'anatomia
di un mollusco.
Materiale:
- Moscardino (o polpo, seppia o calamaro) intero
Strumenti:
- Vaschetta di plastica
- Bisturi
- Pinzette
- Guanti
Procedimento:
- Lavare il moscardino
- Osservarne l'aspetto esteriore, in particolare tentacoli (se presente l'ectocotilo), membrana tra i tentacoli, bocca, occhi, mantello e sue aperture, sifone, ano.
- Con il bisturi, tagliare il mantello per tutta la sua lunghezza, facendo due tagli laterali a partire dall'apertura, in modo da mettere in mostra il sacco dei visceri.
- Osservare l'interno del mantello, in particolare le branchie e, eventualmente, l'ovario.
- Con il bisturi, tagliare delicatamente il sacco dei visceri, facendo attenzione a non rompere gli organi interni.
- Osservare gli organi interni, in particolare epatopancreas, tubo digerente con gozzo, stomaco, cieco e sacco dell'inchiostro vicino all'ano; cuori branchiali e cuore sistemico, reni.
- Con il bisturi, praticare delicatamente un'incisione dorsale dalla bocca alla “nuca” (dietro gli occhi) in modo da estrarre il becco, il cranio e gli occhi.
- Osservare il becco, il cranio con il cervello e gli occhi. Di questi ultimi, osservarne attentamente l'anatomia.
Riferimenti:
Concentrazione minima inibente
Durata:
1 ora (preparazione del terreno) + 1
ora (sterilizzazione) + 2 ore (diluizione antibiotico e semina) + 2
giorni (incubazione) + ½ ora (osservazione piastre)
Inoltre, deve essere già pronta la brodocoltura (3 ore di
preparazione + 2 giorni di incubazione)Scopo:
Individuare la concentrazione minima
di antibiotico necessaria a inibire la crescita di un ceppo
batterico.
Teoria:
L'amoxicillina è un antibiotico del
gruppo delle penicilline, che bloccano la sintesi del peptidoglicano,
impedendo la produzione della parete cellulare delle cellule
batteriche. L'acido clavulanico va a bloccare le beta-lattamasi,
enzimi prodotti da alcuni batteri che neutralizzerebbero
l'amoxicillina.
Materiale:
- Brodocoltura di Lactobacillus bulgaricus
e Streptococcus termophilus
(ottenuti dallo yogurt)
- Antibiotico (Amoxicillina + Acido
Clavulanico)
- Terreno di coltura (MRS Agar),
sterilizzato e liquido (>40 °C)
Strumenti:
- 6 piastre Petri, sterili
- 1 beuta con 100 mL di acqua
distillata, sterile
- 3 provette con 9 mL di acqua
distillata, sterile
- 4 pipette graduate, sterili
- mortaio e pestello
- vetrino da orologio
- spatola
- bilancia tecnica
- becco Bunsen
Procedimento:
- Etichettare
le piastre in questo modo:
- C.T.
(controllo terreno)
- senza
antibiotico
- 1 - 100 mg/L
- 2 - 10 mg/L
- 3 - 1 mg/L
- 4 - 0,1 mg/L
- Numerare la
beuta (1) e le provette (2, 3, 4)
- Pesatura dell'antibiotico
- Pesare una
pastiglia di antibiotico
- Calcolare
la massa di pastiglia che contiene 0,1 g di antibiotico:
- Triturare la
pastiglia nel mortaio
- Pesare sul
vetrino da orologio la massa appena calcolata
- Pesare una
pastiglia di antibiotico
- Accendere il Bunsen: da questo
punto in poi, tutto il procedimento verrà svolto sterilmente vicino
alla fiamma
- Preparazione delle diluizioni
di antibiotico
- Aprire la
beuta, tenendo in mano il tappo di cotone, versarvi dentro
l'antibiotico pesato sul vetrino da orologio, e richiuderla
- Agitare
la beuta 1
- Aprire la
confezione di una pipetta sterile.
- Aprire
la beuta 1,
prelevare 1 mL di soluzione con la pipetta sterile e richiudere la
beuta.
- Aprire
la piastra 1,
versarvi il contenuto della pipetta, richiudere la piastra.
- Aprire
la beuta 1,
prelevare 1 mL di soluzione con la stessa pipetta e richiudere la
beuta.
- Aprire
la provetta 2,
versarvi il contenuto della pipetta, richiudere la provetta.
- Agitare
la provetta 2,
mettere da parte la pipetta.
- Aprire la
confezione di una nuova pipetta sterile.
- Aprire
la provetta 2,
prelevare 1 mL di soluzione con la pipetta sterile e richiudere la
provetta.
- Aprire
la piastra 2,
versarvi il contenuto della pipetta, richiudere la piastra.
- Aprire
la provetta 2,
prelevare 1 mL di soluzione con la pipetta e richiudere la
provetta.
- Aprire
la provetta 3,
versarvi il contenuto della pipetta, richiudere la provetta.
- Agitare
la provetta 3,
mettere da parte la pipetta.
- Aprire la
confezione di una nuova pipetta sterile.
- Aprire
la provetta 3,
prelevare 1 mL di soluzione con la pipetta sterile e richiudere la
provetta.
- Aprire
la piastra 3,
versarvi il contenuto della pipetta, richiudere la piastra.
- Aprire
la provetta 3,
prelevare 1 mL di soluzione con la pipetta e richiudere la
provetta.
- Aprire
la provetta 4,
versarvi il contenuto della pipetta, richiudere la provetta.
- Agitare
la provetta 4,
mettere da parte la pipetta.
- Aprire la
confezione di una nuova pipetta sterile.
- Aprire
la provetta 4,
prelevare 1 mL di soluzione con la pipetta sterile e richiudere la
provetta.
- Aprire
la piastra 4,
versarvi il contenuto della pipetta, richiudere la piastra.
- Aprire la
beuta, tenendo in mano il tappo di cotone, versarvi dentro
l'antibiotico pesato sul vetrino da orologio, e richiuderla
- Semina della coltura
- Aprire la
confezione di una nuova pipetta sterile
- Agitare la
provetta con la coltura batterica
- Tenendola
con la mano sinistra, aprire il tappo della provetta con la coltura
batterica e flambarne l'imboccatura.
- Prelevare 1
mL di coltura con la pipetta.
- Flambare
l'imboccatura della provetta e richiuderla
- Versare 0,5
mL in due piastre, facendo attenzione a non toccare la goccia di
soluzione di antibiotico
- Ripetere i
punti da 2 a 6 in modo da inoculare tutte le piastre tranne la
piastra CT
- Aprire la
confezione di una nuova pipetta sterile
- Primo strato di terreno
- Aprire il
contenitore del terreno, e flambarne l'imboccatura
- Scostare il
coperchio di una piastra
- Versarvi il
terreno, in modo che ne copra circa 3/4
- Richiudere
la piastra e muoverla sul bancone con un movimento a 8 in modo che
il terreno si sparga su tutta la piastra e si mescoli con la
coltura e con l'antibiotico.
- Spostare la
piastra vicino al Bunsen, scostare il coperchio.
- Ripetere i
punti da 2 a 5 per tutte le piastre.
- Flambare
l'imboccatura del contenitore e richiuderlo.
- Aprire il
contenitore del terreno, e flambarne l'imboccatura
- Secondo strato di terreno
- Quando il
primo strato si sarà solidificato, ripetere la procedura
utilizzata per creare un secondo strato di terreno.
- Lasciar
raffreddare le piastre semiaperte vicino al Bunsen
- Quando il
primo strato si sarà solidificato, ripetere la procedura
utilizzata per creare un secondo strato di terreno.
- Incubare a 41° C per 2 giorni,
con un becher pieno d'acqua per prevenire l'essiccamento delle
piastre.
- Osservare in quali piastre è
avvenuta una crescita batterica
Risultato:
Le piastre
dovrebbero presentarsi così:
|
Piastra |
Crescita |
|
1 |
Nessuna (piastra trasparente) |
|
2 |
Nessuna (piastra trasparente) |
|
3 |
Scarsa (osservabile allo stereomicroscopio) |
|
4 |
Buona (piastra opaca) |
|
Senza antibiotico |
Buona (piastra opaca) |
|
Controllo terreno |
Nessuna (piastra trasparente) |
Commenti:
Utilizzare
un'abbondante quantità di terreno per evitare l'essiccamento. Si
potrebbe provare l'esperienza con un batterio aerobio come
Escherichia coli.
Colorazione di Gram
Durata: 1 ora
Scopo:
Distinguere i batteri Gram + dai
batteri Gram -
Teoria:
I batteri possono avere due
diversi tipi di parete cellulare, con una minore o maggiore quantità
di peptidoglicano. Il primo colorante (cristalvioletto) entra nelle
cellule con entrambi i tipi di parete, ma solo quelle con la parete
ad alto contenuto di peptidoglicano lo trattengono, al momento del
lavaggio con la soluzione decolorante, risultando quindi colorate di
viola. I batteri con la parete a minor contenuto di peptidoglicano,
invece, perdono il primo colorante, così che risultano colorati solo
dal colorante di contrasto (safranina, rosso/rosa).
Materiale:
- Piastra contenente la colonia da osservare
- Soluzione fisiologica
- Kit per la colorazione di Gram (Cristalvioletto, Lugol,
soluzione decolorante, safranina)
- Acqua per lavaggi
Strumenti:
- Vetrino portaoggetti
- Pinza di legno per vetrini
- Ansa
- Becco Bunsen
Procedimento:
- Prelievo del campione (lavorare vicino alla fiamma o sotto cappa a flusso laminare)
- Depositare una goccia di
soluzione fisiologica sul vetrino portaoggetti
- Sistemare la piastra capovolta
vicino alla fiamma
- Sterilizzare l'ansa, lasciarla
raffreddare 15''
- Sollevare il fondo della
piastra, prelevare con l'ansa una piccola parte di colonia, e
richiudere la piastra
- Stemperare con l'ansa il
campione prelevato nella goccia di soluzione fisiologica sul
vetrino
- Sterilizzare l'ansa
- Depositare una goccia di
soluzione fisiologica sul vetrino portaoggetti
- Fissazione del vetrino
- Lasciar asciugare il vetrino
tenendolo relativamente vicino alla fiamma, ma senza scottarlo (una
mano, alla stessa distanza, non deve scottarsi)
- Tagliare tre volte la fiamma col
vetrino, tenendo il lato con i microrganismi verso l'alto
- Lasciar asciugare il vetrino
tenendolo relativamente vicino alla fiamma, ma senza scottarlo (una
mano, alla stessa distanza, non deve scottarsi)
- Colorazione
- Coprire il campione con una
goccia di cristalvioletto, attendere 1'
- Lavare delicatamente con poca
acqua
- Coprire il campione con una
goccia di soluzione di Lugol, attendere 1'
- Lavare delicatamente con poca
acqua
- Versare goccia a goccia la
soluzione decolorante, finché il campione non rilascia più colore
- Lavare delicatamente con poca
acqua
- Coprire il campione con una
goccia di safranina, attendere 1'
- Lavare delicatamente con poca
acqua
- Asciugare all'aria o alla fiamma
- Coprire il campione con una
goccia di cristalvioletto, attendere 1'
- Osservare al microscopio
Risultato:
I batteri Gram + dovrebbero risultare
blu/violetti, mentre quelli Gram – dovrebbero risultare rosso/rosa.
Esempi di microrganismi Gram -: Escherichia coli (usare solo ceppi selezionati non patogeni), Acetobacter aceti.
Commenti:
La
colorazione di Gram è di difficile riuscita, occorre eseguirla con
cura e fare diverse prove.
Esempi di microrganismi Gram +:
Lactobacillus casei,
Lactobacillus bulgaricus, Streptococcus thermophilus
(anche i lieviti risultano Gram +, pur avendo una parete cellulare
differente)Esempi di microrganismi Gram -: Escherichia coli (usare solo ceppi selezionati non patogeni), Acetobacter aceti.
Coltivare i batteri dello yogurt
Lo yogurt è ottenuto dalla fermentazione del latte operata da alcuni batteri, chiamati per questo fermenti lattici. Questi rimangono vivi nello yogurt, e possono entrare a far parte della flora batterica intestinale, diventando così simbionti del nostro organismo.
Lo scopo di questa esperienza è di coltivare i fermenti lattici, e osservare la coltura ottenuta.
Lo yogurt è ottenuto dalla fermentazione del latte operata da alcuni batteri, chiamati per questo fermenti lattici. Questi rimangono vivi nello yogurt, e possono entrare a far parte della flora batterica intestinale, diventando così simbionti del nostro organismo.
Titolazione argentometrica secondo Mohr
Durata: 1 ora
Scopo:
Determinare la concentrazione di cloruri in un campione.
Teoria:
Titolando una soluzione di cloruro di
sodio con nitrato di argento avviene la reazione:
NaCl (aq) + AgNO3 (aq) → NaNO3 (aq) + AgCl (s)
Il cloruro d'argento è un sale insolubile bianco, che precipita. Quando reagiscono tutti i cloruri, in presenza di cromato di potassio inizia a precipitare cromato d'argento, un sale rosso mattone meno insolubile del cloruro d'argento:
K2CrO4 (aq) + 2 AgNO3 (aq) → 2 KNO3 (aq) + Ag2CrO4 (s)
NaCl (aq) + AgNO3 (aq) → NaNO3 (aq) + AgCl (s)
Il cloruro d'argento è un sale insolubile bianco, che precipita. Quando reagiscono tutti i cloruri, in presenza di cromato di potassio inizia a precipitare cromato d'argento, un sale rosso mattone meno insolubile del cloruro d'argento:
K2CrO4 (aq) + 2 AgNO3 (aq) → 2 KNO3 (aq) + Ag2CrO4 (s)
Materiale:
- NaCl concentrazione incognita (circa 0,1 o 0,2 M)
- AgNO3 0,1 M
- K2CrO4 1%
- Acqua distillata
Strumenti:
- Buretta
- Pipetta tarata da 10 mL
- Propipetta
- Becher
- Agitatore magnetico e ancoretta
- Cappa aspirante
Procedimento (lavorare sotto cappa aspirante):
- Avvinare la buretta e riempirla con la soluzione di nitrato
d'argento, portandola alla tacca dello zero.
- Prelevare 10 mL di soluzione incongnita di NaCl e versarli
nel becher
- Aggiungere acqua distillata fino a 50 mL
- Aggiungere alcune gocce di soluzione di cromato di potassio
- Aggiungere l'ancoretta magnetica, e sistemare il becher
sull'agitatore sotto la buretta
- Agitando, titolare con nitrato d'argento fino alla formazione
di un precipitato rosso mattone persistente
- Calcolare la concentrazione di NaCl
Solubilità del cloruro di sodio
Tutti sappiamo che il sale da cucina si scioglie in acqua.
Sappiamo anche che, però si scioglie solo fino ad un certo punto: nel mar Morto e in altri mari chiusi e laghi salati, dove avviene molta evaporazione, si formano depositi di sale; nelle saline l'acqua marina viene fatta evaporare per far cristallizzare il sale che viene poi raccolto; così come si lascia del sale nella salamoia per la salatura dei formaggi per far sì che la soluzione sia sempre satura.
Con questa esperienza cercheremo di determinare qual è la massima concentrazione di sale che si può sciogliere in acqua.
Sappiamo anche che, però si scioglie solo fino ad un certo punto: nel mar Morto e in altri mari chiusi e laghi salati, dove avviene molta evaporazione, si formano depositi di sale; nelle saline l'acqua marina viene fatta evaporare per far cristallizzare il sale che viene poi raccolto; così come si lascia del sale nella salamoia per la salatura dei formaggi per far sì che la soluzione sia sempre satura.
Con questa esperienza cercheremo di determinare qual è la massima concentrazione di sale che si può sciogliere in acqua.
Diluizione di soluzioni
In laboratorio si utilizzano molto spesso soluzioni a varie concentrazioni: ma come si preparano, e come si fa a conoscerne la concentrazione?
In questa esperienza impareremo a preparare una soluzione a concentrazione nota, partendo da una soluzione più concentrata, sapendo che la quantità di sostanza di soluto contenuta nell'aliquota di soluzione concentrata che useremo rimane la stessa anche diluendo la soluzione, semplicemente sarà distribuita in un volume maggiore, e quindi la sua concentrazione sarà minore, e calcolabile.
In questa esperienza impareremo a preparare una soluzione a concentrazione nota, partendo da una soluzione più concentrata, sapendo che la quantità di sostanza di soluto contenuta nell'aliquota di soluzione concentrata che useremo rimane la stessa anche diluendo la soluzione, semplicemente sarà distribuita in un volume maggiore, e quindi la sua concentrazione sarà minore, e calcolabile.
Fusione e solidificazione del tiosolfato di sodio
Se forniamo calore ad un solido, la sua temperatura aumenta.
Questo, almeno, finché non raggiungiamo la sua temperatura di fusione. A questo punto, la temperatura cessa di aumentare, perché il calore aggiunto, anziché aumentare l'agitazione delle molecole, va a rompere i legami deboli che tengono le molecole fisse nel reticolo cristallino. Una volta che tutta la sostanza è passata alla fase liquida, il calore ricomincia ad aumentare il grado di agitazione delle molecole e la temperatura ricomincia a salire.
Se, al contrario, sottraiamo calore ad un liquido, avviene il processo inverso, con una differenza. Nel momento in cui la temperatura si abbassa fino a raggiungere la temperatura di solidificazione, le molecole del liquido possono iniziare ad aggregarsi in un reticolo cristallino ordinato, ma per far questo hanno bisogno di un germe di cristallizzazione, cioè un cristallo, anche piccolissimo, attorno al quale legarsi e "costruire" il nuovo cristallo. Se questo germe non è presente, il liquido non solidifica, e quindi il calore sottratto continua a diminuire l'agitazione molecolare, e la temperatura scende anche al di sotto della temperatura di solidificazione. Quando però i cristalli iniziano a formarsi, questo processo esotermico rilascia calore alla sostanza, e la temperatura può risalire fino alla temperatura di solidificazione. Quando poi tutta la sostanza è solidificata, ricomincia il normale raffreddamento.
Questo, almeno, finché non raggiungiamo la sua temperatura di fusione. A questo punto, la temperatura cessa di aumentare, perché il calore aggiunto, anziché aumentare l'agitazione delle molecole, va a rompere i legami deboli che tengono le molecole fisse nel reticolo cristallino. Una volta che tutta la sostanza è passata alla fase liquida, il calore ricomincia ad aumentare il grado di agitazione delle molecole e la temperatura ricomincia a salire.
Se, al contrario, sottraiamo calore ad un liquido, avviene il processo inverso, con una differenza. Nel momento in cui la temperatura si abbassa fino a raggiungere la temperatura di solidificazione, le molecole del liquido possono iniziare ad aggregarsi in un reticolo cristallino ordinato, ma per far questo hanno bisogno di un germe di cristallizzazione, cioè un cristallo, anche piccolissimo, attorno al quale legarsi e "costruire" il nuovo cristallo. Se questo germe non è presente, il liquido non solidifica, e quindi il calore sottratto continua a diminuire l'agitazione molecolare, e la temperatura scende anche al di sotto della temperatura di solidificazione. Quando però i cristalli iniziano a formarsi, questo processo esotermico rilascia calore alla sostanza, e la temperatura può risalire fino alla temperatura di solidificazione. Quando poi tutta la sostanza è solidificata, ricomincia il normale raffreddamento.
Sublimazione dello iodio
Fusione, solidificazione, ebollizione e condensazione sono passaggi di stato ben conosciuti da tutti; ce ne sono altri due, però, non così comuni: la sublimazione e il brinamento.
Lo iodio è una sostanza che, a pressione standard e temperature facilmente ottenibili in laboratorio, può dar luogo a questi fenomeni, che osserveremo in questa esperienza.
Lo iodio è una sostanza che, a pressione standard e temperature facilmente ottenibili in laboratorio, può dar luogo a questi fenomeni, che osserveremo in questa esperienza.
Ebollizione dell'alcool a bassa pressione
Quasi tutti sanno che, in alta montagna, l'acqua bolle a temperatura minore, e quindi la pasta ci mette più tempo a cuocere. Perché questo? Perché la temperatura di ebollizione dipende dalla pressione atmosferica.
Quindi, se la pressione è abbastanza bassa, è possibile anche un calore leggerissimo, ad esempio il calore delle mani, per far bollire un liquido? Sì, e in questa esperienza lo dimostreremo.
Quindi, se la pressione è abbastanza bassa, è possibile anche un calore leggerissimo, ad esempio il calore delle mani, per far bollire un liquido? Sì, e in questa esperienza lo dimostreremo.
Fusione e ebollizione dell'acqua
La fusione del ghiaccio e l'ebollizione del'acqua sono tra i fenomeni fisici più conosciuti da tutti, ma li abbiamo mai osservati da un punto di vista scientifico?
Con questa esperienza andremo a osservare quello che succede durante questi passaggi di stato, e come varia la temperatura nel tempo.
Con questa esperienza andremo a osservare quello che succede durante questi passaggi di stato, e come varia la temperatura nel tempo.
Miscugli e composti
Quello che distingue un miscuglio da un composto è che, nel primo, i componenti mantengono le loro proprietà, e sono separabili tramite mezzi chimici, mentre nel secondo i componenti non mantengono le loro proprietà, e per separarli occorre una reazione chimica.
In questa esperienza osserveremo il ferro e lo zolfo, sia in un miscuglio che in un composto, e verificheremo se è possibile separarli utilizzando una calamita, e se il ferro continua a reagire nello stesso modo con gli acidi.
In questa esperienza osserveremo il ferro e lo zolfo, sia in un miscuglio che in un composto, e verificheremo se è possibile separarli utilizzando una calamita, e se il ferro continua a reagire nello stesso modo con gli acidi.
Metalli e non metalli
La tavola periodica si può dividere in due parti, lungo una linea diagonale che passa tra il boro e l'alluminio, il silicio e il germanio e giù fino al polonio: nell'angolo in alto a destra ci stanno i non metalli, in tutto il resto della tavola ci sono quelli che chiamiamo metalli.
La classica descrizione di un metallo ci dice che esso è "lucente, duttile e malleabile, buon conduttore di calore ed elettricità", tutte qualità che invece un non metallo non ha. Ma è sempre vero? Osservando i pochi elementi puri che si possono maneggiare in sicurezza in laboratorio, verificheremo se questa descrizione si adatta bene a tutti gli elementi, o se ci sono delle eccezioni.
La classica descrizione di un metallo ci dice che esso è "lucente, duttile e malleabile, buon conduttore di calore ed elettricità", tutte qualità che invece un non metallo non ha. Ma è sempre vero? Osservando i pochi elementi puri che si possono maneggiare in sicurezza in laboratorio, verificheremo se questa descrizione si adatta bene a tutti gli elementi, o se ci sono delle eccezioni.
La legge di Lavoisier
In una reazione chimica la massa complessiva dei reagenti è uguale alla massa complessiva dei prodotti.La legge di Lavoisier, così come la legge di Proust, è una delle leggi ponderali su cui si basa la chimica classica. In questa esperienza dimostreremo come, in una reazione, la massa dei prodotti sia uguale alla massa dei reagenti.
La chimica del cavolo
Spesso i reagenti utilizzati in laboratorio, e in particolare gli indicatori acido/base, sono sostanze di sintesi, pericolose e costose. In questa esperienza dimostreremo come è possibile ricavare un indicatore acido/base in modo semplice, ecologico ed economico partendo dalla verdura.
Incertezza di misura
Nessuna misura sperimentale fornisce un valore certo: ad ogni misura è associata un'incertezza.
In questa esperienza valuteremo la diversa incertezza di alcuni diversi strumenti di misura (e non) utilizzati in laboratorio.
In questa esperienza valuteremo la diversa incertezza di alcuni diversi strumenti di misura (e non) utilizzati in laboratorio.
Fumo di sigaretta
Il fumo di sigaretta nuoce alla salute per molti motivi diversi, uno di questi è la presenza di particolato, cioè fini particelle solide in sospensione nell'aria, e i catrami, cioè idrocarburi ad alto peso molecolare, che a temperatura ambiente sono liquidi ad alta viscosità. Il particolato e i catrami si possono accumulare nei polmoni, ostruendo gli alveoli e danneggiando l'epitelio ciliato.
Inoltre, le sostanze solubili contenute nel fumo di sigaretta possono sciogliersi nel sangue, e di qui andare a diffondersi in tutto l'organismo.
In questa esperienza simuleremo il passaggio del fumo di sigaretta nei polmoni, utilizzando un batuffolo di cotone (che rappresenta gli alveoli e l'epitelio ciliato) e una beuta contenente acqua distillata (che rappresenta il sangue).
Inoltre, le sostanze solubili contenute nel fumo di sigaretta possono sciogliersi nel sangue, e di qui andare a diffondersi in tutto l'organismo.
In questa esperienza simuleremo il passaggio del fumo di sigaretta nei polmoni, utilizzando un batuffolo di cotone (che rappresenta gli alveoli e l'epitelio ciliato) e una beuta contenente acqua distillata (che rappresenta il sangue).
Filtrazione
Il succo di frutta è una sospensione di particelle solide (polpa) in una soluzione: è possibile separare queste due componenti facendo passare il succo di frutta attraverso un filtro.
Distillazione frazionata del vino
I liquori e l'alcool vengono da millenni prodotti dalla distillazione di bevande fermentate.
Questo è un processo fisico attraverso il quale è possibile separare due componenti di un miscuglio omogeneo (in questo caso acqua e etanolo) grazie al loro diverso punto di ebollizione.
In questa esperienza effettueremo in laboratorio la distillazione frazionata del vino, per separane l'etanolo.
Questo è un processo fisico attraverso il quale è possibile separare due componenti di un miscuglio omogeneo (in questo caso acqua e etanolo) grazie al loro diverso punto di ebollizione.
In questa esperienza effettueremo in laboratorio la distillazione frazionata del vino, per separane l'etanolo.
Densità dei liquidi
La densità di un corpo è il rapporto tra la sua massa e il volume che occupa.
Nel caso dei liquidi è molto semplice calcolarne la densità, dato che è immediato misurarne la massa e il volume. In questa esperienza determineremo sperimentalmente la densità di alcuni liquidi, e osserveremo il loro comportamento quando sono messi insieme in uno stesso recipiente.
Nel caso dei liquidi è molto semplice calcolarne la densità, dato che è immediato misurarne la massa e il volume. In questa esperienza determineremo sperimentalmente la densità di alcuni liquidi, e osserveremo il loro comportamento quando sono messi insieme in uno stesso recipiente.
Cromatografia dell'inchiostro
Time-lapse della cromatografia (video di Alice Roncella)
La cromatografia è una delle tecniche più diffuse in tutti i laboratori scientifici del mondo per separare miscugli di composti. In questa esperienza vedremo come è possibile effettuarla semplicemente con carta e alcool, per separare i componenti degli inchiostri.
Cristallizzazione
Il sale da cucina viene prodotto facendo evaporare l'acqua di mare.
Questo perché il sale da cucina (cloruro di sodio), come molti altri sali, è solubile in acqua solo fino ad una certa concentrazione (concentrazione di saturazione), oltre la quale non si può più sciogliere.
Se si fa evaporare una soluzione contenente cloruro di sodio, evapora l'acqua ma il sale resta in soluzione, e in questo modo la sua concentrazione aumenta. Quando supera la concentrazione di saturazione, non potendo rimanere in soluzione a concentrazioni superiori, comincia a cristallizzare.
In questa esperienza ricreeremo in laboratorio questo fenomeno.
Centrifugazione
In una sospensione le particelle solide, col tempo, tendono a sedimentare (se sono più dense del liquido) o a galleggiare (se sono meno dense del liquido), guidate dalla forza di gravità e dalla spinta di Archimede. Se sono molto piccole, però, la forza di gravità, ostacolata dalla viscosità del liquido, può metterci parecchio tempo per operare questa separazione.
Per separare le fasi in modo più rapido, quindi, occorre "aiutare" artificialmente la forza di gravità, e questo è possibile farlo, ad esempio, in una centrifuga: facendo ruotare velocemente i contenitori della sospensione, la forza centrifuga spingerà la sospensione verso l'esterno, come se fosse la forza di gravità, ma di intensità che può essere anche molto superiore, a seconda della velocità di rotazione.
Cellule in mitosi
Negli apici delle radici di cipolla c'è un tessuto il cui scopo è quello di produrre nuove cellule: è il meristema apicale. Le cellule del meristema sono tra le poche che mantengono la capacità dividersi tramite mitosi e, essendo il loro compito, lo fanno molto spesso!
Le cellule della cipolla hanno un'altra caratteristica interessante: sono molto grandi.
Per questi due motivi, in questa esperienza utilizzeremo proprio le cellule degli apici radicali di cipolla per osservare al microscopio le varie fasi della mitosi.
La legge di Proust e il reagente limitante
Due o più elementi si combinano per formare un determinato composto secondo proporzioni definite e costantiLa Legge di Proust è una delle leggi ponderali che stanno alla base della chimica.
Nella maggior parte delle reazioni, se io ho una certa quantità del reagente A, questa reagirà sempre con una stessa quantità di reagente B per dare il prodotto C.
Se, ad esempio, il rapporto stechiometrico (in moli) è 1:1, una mole di reagente A reagisce con una mole di reagente B per dare una mole di prodotto C.
Se io metto insieme una mole di A e due moli di B, la mole di A reagirà comunque con solo una delle due moli di reagente B, per dare una mole di prodotto C.
Se metto insieme una mole di A e mezza mole di B, solo mezza mole di A riuscirà a reagire, perché consumerà tutta la mezza mole di B, e non ne rimarrà più per far reagire la restante mezza mole di A. Ovviamente in questo caso si formerà solo mezza mole di C.
La reazione quindi procede consumando quantità di A e B in rapporto 1:1, finché uno dei due reagenti non si esaurisce: a quel punto la reazione termina. Il reagente che si esaurisce per primo si chiama reagente limitante, perché è la sua quantità che determina la quantità massima di prodotto che si può formare.
In questa esperienza dimostreremo la legge di Proust, dimostrando come la quantità di prodotti di una reazione dipenda dalla quantità di reagente limitante.
Iscriviti a:
Post (Atom)